CRISPR/Cas9基因编辑技术在人类病毒性传染病中的应用
作者:许黎黎 2020-05-21 10:09:47 浏览次数:
规律成簇间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats, CRISPR)广泛存在于古细菌及细菌中,是细菌在长期进化过程中形成的一种获得性免疫系统。近年来以该系统为基础,经过人工改造形成的一种新型基因编辑技术-CRISPR/Cas9在基因工程领域的应用越发广泛。CRISPR/Cas9系统由可以整合外源DNA片段的CRISPR和发挥剪切作用的Cas9核酸内切酶构成,在一段特殊的RNA序列引导下对目的片段进行切割。该技术与前两代编辑技术相比,具有结构简单、成本低廉、实用价值较高等优点。目前CRISPR/Cas9技术已成功应用于人类细胞、小鼠、斑马鱼、食蟹猴、非洲爪蟾、果蝇、烟草、水稻及拟南芥等真核生物的基因编辑中。近年来,该技术也逐步被用于对病原微生物的研究中,利用CRISPR/Cas9系统可对病原微生物的基因进行敲除,并通过相关实验推测基因功能,而且该系统特异性较高,在效率上已明显优于传统方法。除了在敲除方面的应用外,该系统经过改造还可以对基因进行插入,沉默和定向调控。下表列举了CRISPR/Cas9在几种人类重要传染性病毒上的应用情况及面临的问题。
| 病毒名称 | 种类特征 | 靶向位置 | 研究模型 | 作用 | 效果 | CRISPR/Cas9系统面临的问题 |
| 乙型肝炎病毒(HBV) | DNA病毒, 基因组为部分双螺旋的环状DNA | HBV基因组的开放阅读框 (S区, C区, P区, X区) | 细胞模型 动物模型 | 特异性地靶向和切割HBV基因组中的保守区域 | 有效抑制了病毒基因表达和复制 | 不能彻底消除病毒;潜在的脱靶效应;在病毒基因组靶点位置的选择会影响切割效率;在高压尾静脉水动力小鼠模型中, 血清中的HBsAg降低, 但在CRISPR/Cas9处理后仍然存在。需要具有高载体与靶细胞比率的有效递送系统, 例如腺病毒或腺相关病毒载体,以携带CRISPR/Cas9系统。 |
| 丙型肝炎病毒(HCV) | RNA病毒,基因组为单股正链RNA | 对病毒适应性重要的病毒遗传元件;相关具有抗病毒活性的基因 | 细胞模型 | 探究HCV相关的分子机制 | 揭示调节HCV的分子机制 | 脱靶效应;CRISPR系统及其与基因递送载体的相容性。 |
| Epstein-Barr病毒(EBV) | DNA病毒,基因组是线性双链DNA | EBV基因组的开放阅读框;对病毒适应性重要的病毒遗传元件; | 细胞模型 | 使病毒基 因组链断裂;探究相关元件分子机制 | 减弱病毒复制和清除潜伏病毒感染;揭示相关元件的分子机制 | 脱靶效应;靶点位置不同, 会影响CRISPR/Cas9活性。 |
| 单纯疱疹病毒(HSV) | DNA病毒,基因组为双链线性DNA | HSV的基因组;对病毒适应性重要的病毒遗传元件 | 细胞模型 | 特异性靶向和断裂HSV的基因组DNA;探究相关元件分子机制 | 有效消除HSV复制和抑制表达;揭示相关元件的分子机制 | 脱靶效应;靶点位置不同, 会影响CRISPR/Cas9活性。 |
| 寨卡病毒(ZIKV) | RNA病毒,基因组为单股正链RNA | 将基因组扩增后的序列;相关具有抗病毒活性的基因 | 细胞模型 | 快速检测诊断;探究ZIKV复制的分子机制 | 方便临床检测样本中ZIKV序列;揭示ZIKV复制的分子机制 | 在利用CRISPR/Cas9筛选基因组中, 使用细胞存活作为读数显示, 灵敏度有限。 |
| 人类免疫缺陷病毒(HIV) | RNA病毒,基因组为两条相同的正链RNA | HIV复制周期中的DNA中间体;HIV感染过程中相关蛋白质的基因 | 细胞模型 | 特异性靶向和切割HIV复制周期中的DNA中间体;对HIV感染过程中相关蛋白质的基因进行基因编辑 | 破坏潜在整合的病毒 基因组, 并且能长期适应性防御人类细胞中新病毒感染、表达和复制;揭示HIV相关蛋白对HIV 的影响 | 脱靶效应, 可能导致非特异性基因修饰事件发生;CRISPR/Cas9系统靶向高度可变的病毒HIV, 功效在很大程度上取决于gRNA与靶病毒DNA序列的匹配程度;产生病毒逃逸。 |
CRISPR/Cas9系统作为一种新型靶向DNA的基因编辑工具, 目前除了上述所列举的病毒外,它在埃博拉病毒 (EBoV) 、Kaposi肉瘤相关疱疹病毒 (KSHV) 、JC多瘤病毒 (JCV) 等病毒中也有所应用。但是, 目前CRISPR/Cas9技术大部分应用仍停留于细胞模型和动物模型阶段。从临床前研究进入临床试用的突破, 尚需克服脱靶效应、递送工具的优化及递送效率低、伦理学批文等诸多技术瓶颈问题。相信通过不断的改进和完善, 该系统能在不同层次的研究上得到更广阔的发展和应用。
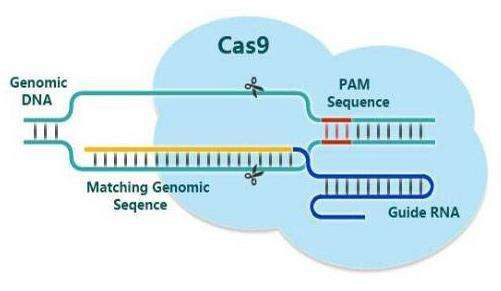
图1 CRISPR/Cas9工作示意图
参考文献:
[1] Haurwitz RE, Jinek M, Wiedenheft B, et al. Sequence-and structure-specific RNA processing by a CRISPR endonuclease. Science, 2010, 329 (5997): 1355-1358.
[2] Makarova KS, Haft DH, Barrangou R, et al. Evolution and classification of the CRISPR-Cas systems. Nat Rev Microbiol, 2011, 9 (6): 467-477.
[3] Hsu PD, Lander ES, Zhang F.Development and applications of CRISPR-Cas9for genome engineering. Cell, 2014, 157 (6): 1262-1278.
上一篇: 宏基因组二代测序临床应用














